
✅ This article is a compilation of research reviews for study purposes. It was not written for commercial purposes. If there are any issues, it will be deleted.
✅ It's written in Korean, so if you need other language, click the translate button and read it.
논문 소개
본 논문은 “조영제를 사용하지 않는(non-contrast) 초음파 기반 고해상도 미세혈관 영상 기법(High-definition microvasculate imaging;HDMI)과 이에 기반한 새로운 정량 바이오마커를 이용하여 유방 병변의 악성 여부를 보다 정확하게 구분하는 방법을 제안하고 있습니다. 기존 초음파 Doppler 기법은 종양 혈관의 느린 흐름이나 미세한 구조를 충분히 파악하지 못하는 한계가 있었고, 조영제 기반의 초음파는 침습성과 비용 부담이라는 단점이 따라옵니다.
이에 본 연구는 이러한 한계를 극복하기 위해 고해상도 미세혈관 영상을 획득했고, 혈관의 복잡성, 분기 구조, 공간 분포를 수치화하는 새로운 바이오마커를 도입하였습니다. 그 결과 기존 지표 대비 유방암 진단 정확도를 유의미하게 향상시킬 수 있음을 대규모 임상 데이터로 증명하며 초음파 기반의 유방암 진단의 정량화 가능성을 제시하고 있습니다.
배경
Breast cancer는 종양의 성장과 진행 과정에서 비정상적인 혈관 신생(angiogenesis)이 동반되는 대표적인 질환으로 종양 내부와 주변의 미세혈관 구조는 악성 여부를 반영하는 중요한 생물학적, 임상적 단서로 알려져 있다. 악성 종양의 혈관은 일반적으로 그 굵기와 분기 구조가 불균일하고 심한 굴곡과 복잡한 형태를 띄는 반면 양성 병변에서는 비교적 규칙적이고 안정된 혈관 구조가 관찰된다. 그러나 기존의 color doppler나 power doppler 초음파는 빠른 혈류에만 민감(clutter filter에 의해 낮은 doppler frequency가 잘려서 표현할 수 있는 속도에 하한이 생김)해 미세혈관(직경 < 0.1 mm)을 대상으로는 단편적인 측정만 가능하며 혈관의 형태학적 특성을 정량적으로 분석하는 데에는 한계가 있다[Schroeder RJ, Bostanjoglo M, Rademaker J, Maeurer J, Felix R. Role of power Doppler techniques and ultrasound contrast enhancement in the differential diagnosis of focal breast lesions. Eur Radiol 2003;13:68-79].
이 한계를 극복하기 위해서 조영 증강 초음파(CEUS)는 미세혈관 가시성을 개선할 수 있다는 장점이 있지만 조영제를 주입해야 함에 따라 침승성, 비용 증가, 반복 검사에 대한 부담이라는 현실적인 제약이 단점으로 따르게 된다.
이러한 이유로 조영제 없이 미세혈관을 고해상도로 영상화하고 혈관 구조를 객관적인 수치로 표현할 수 있는 정량적 바이오마커에 대한 요구가 지속적으로 제기되어 왔고 본 논문은 이 임상적, 기술적 공백을 해결하고자 한다.
아이디어
이 논문의 핵심 아이디어는 종양의 미세혈관 구조는 암의 생물학적 특성을 반영하며 이를 정략적으로 측정하면 진단 정확도를 높일 수 있다는 가설에 기반한다. 저자들은 조영제를 사용하지 않고도 초음파 기반으로 수백 마이크로미터 수준의 미세혈관을 시각화할 수 있는 quantative High-definition Microvasculature Imaging(qHDMI) 기법을 개발하고 이를 활용하여 단순한 혈류 유무나 밀도 지표를 뛰어넘어 혈관의 형태학적 특성 자체를 수치화하는 데 초점을 둔다. 또한 기존 연구에서 제한적으로 사용되던 지표 대신 종양 혈관의 구조적 불규칙성과 비정상성을 직접 반영할 수 있는 네 가지 새로운 정량 바이오마커를 제안한다.
구체적으로는 혈관 구조의 복잡도를 나타내는 미세혈관 프랙탈 차원(mvFD), 정상 혈관 분기 법칙에서의 이탈 정도를 측정하는 Murrays’ deviation(MD), 혈관 분기 시 기하학적 특성을 반영하는 bifurcation angle(BA), 그리고 혈관이 병변 중심부 또는 주변주에 분포하는 양상을 나타내는 spatial vascularity pattern(SVP)를 통해 종양 혈관의 비정상 임상 특징을 구하게 된다.
이들 지표는 단순히 “혈관이 많다, 또는 적다”를 넘어 암에서 흔히 관찰되는 비정상 신생 혈관의 정량적 특성을 반영하도록 설계되었다. 저자들은 이러한 바이오마커들이 서로 낮은 상관관계를 가져 상호 보완적인 정보를 제공할 수 있으며, 이를 결합할 경우 단일 지표보다 우수한 분류 성능을 달성할 수 있다는 점을 본 논문 연구의 핵심 기여로 설정하였다.
시스템 구조
데이터 획득: Plane wave imaging & High frame rate
초음파 검사는 15년 이상의 US 스캔 경험을 가진 두 명의 초음파 검사자에 의해 수행되었다. 초음파 검사자들은 조직 미세혈관에 대한 원치 않는 압력을 줄이기 위해서 voltage를 최소화하도록 지시를 받았고, 불필요한 artifact를 줄이기 위해 3초 동안 환자들의 호흡을 멈추라고 지시했다.
평면파 이미징 기능(Alpinion Ecube12-R, ALPINION Medical Systems)을 갖춘 초음파 플랫폼과 L3-12H 선형 배열을 사용하여 8.5 MHz의 center frequency에서 작동시켰다. 유방 병변은 평면파 B-모드에서 식별되었다. 이후 병변 부위에서 약 600 fps 수준으로 데이터를 확보한다. 오프라인에서 미세혈관 신호 분리 및 정량 분석을 수행할 수 있도록 단순 영상이 아닌 raw IQ beamfromed data형태로 저장한다. 각 프레임은 5 angles coherent compounding 방식으로 결합한다.
HDMI 영상 획득 방법
HDMI 영상은 조직 신호(clutter)와 미세혈관 혈류 신호를 분리하는 신호 처리 파이프라인을 통해 생성된다. 각 단계에 대해서 더 자세한 내용을 원한다면 짙은 배경의 문단을 참고하면 된다.
먼저, high frame-rate 데이터에 대해 singular value decomposition(SVD) 기반 clutter filtering이 적용된다. 이 방법은 공간-시간 데이터의 특성을 singular spectrum영역에서 분석하여, 강한 조직 에코 성분과 상대적으로 약하지만 시간적 변동성이 있는 혈류 성분을 효과적으로 분리한다. 조직 clutter의 rank는 singular value 감소율을 기반으로 자동으로 결정된다.

SVD 처리 후 남은 clutter 잡음을 줄이기 위해 Doppler 신호의 강도 불균일성을 완화하는 2-step background suppression 알고리즘이 적용된다.

그다음 단계에서 morphology-based filtering을 이용하여 전역, 국소 잡음을 제거하고 최종적으로 multi-scale Hessian-based vessel enhancement filter를 사용해 관 형태 구조를 선택적으로 강조한다.
이 과정을 통해 직경 약 300 µm 수준의 sub-millimeter 미세혈관이 연속적인 구조로 시각화된 HDMI 영상이 생성된다. 이 HDMI 영상은 이후 정량 분석을 위한 입력 데이터로 사용된다.
HDMI 4가지 biomarker 계산 방법
바이오마커 계산을 위해, 먼저 B-mode 영상에서 병변 경계를 기준으로 ROI를 정의하고 주변 혈관을 포함하기 위해 ROI를 2mm 확장한다. HDMI 영상은 ROI 내에서 이진화(binary conversion)된 후 침식, 팽창 연산을 통해 작은 잡음 객체가 제거된다. 이후 thinning 알고리즘을 이용해 혈관 중심선을 추출하고, vessel skeleton을 구성하여 branch point와 vessel segment를 식별한다. 이 구조를 기반으로 네 가지 신규 바이오마커가 계산된다.
mvFD는 box-counting 방법을 사용해 혈관 네트워크의 공간적 복잡도를 프랙탈 차원으로 정량화한다. BA는 각 branch point에서 두 daughter vessel 간의 각도를 계산한다. MD는 mother-daughter vessel 직경 관계가 Murray’s law에서 얼마나 벗어나는지 측정하여 비정상 혈관 분기를 반영한다. 마지막으로 SVP는 병변 중심부와 주변부의 vessel density 비율(VDR)을 계산해, 혈관 분포가 중심형인지 주변형인지를 lesion 크기에 따라 해석한다. 이 네 지표는 서로 다른 혈관 생물학적 특성을 반영하도록 설계되었다.
로지스틱 회귀 분석
계산된 HDMI 바이오마커들은 multivariable logistic regression 모델의 입력 변수로 사용되어 병변의 악성 확률을 예측한다. 각 바이오마커는 회귀 계수를 통해 예측에 기여하며, 이 조합은 단일 지표보다 높은 분류 성능을 보인다. 또한 기존 임상 판독 지표인 BI-RADS 점수를 함께 포함함으로써 정량 HDMI 정보가 실제 임상 판단을 어떻게 보완할 수 있는지를 평가한다. 모델의 출력은 연속적인 malignancy probability로 제공되며, 특정 임계값을 기준으로 추적 관찰 도는 생검 권고를 지원하는 decision-support 도구로 활용될 수 있도록 설계되었다.
학습 및 추론, 실험
연구 설계 및 데이터 구성: 신뢰성을 확보한 임상 기반 실험
논문의 연구는 단일 기관에서 수행된 전향적(prospective) 임상 연구로, 총 512명의 환자에서 527개의 유방 병변을 대상으로 한다. 모든 병변은 임상 초음파 검사 후 생검이 예정된 경우로, 연구진은 HDMI 결과를 임상 판독이나 생검 결정에 사용하지 않고 완전히 블라인드된 상태에서 분석을 수행하였다. 각 병변의 최종 진단은 core needle biopsy 병리 결과 gold standard로 사용하였다. 이는 양성 병변에서는 수술 병리가 존재하지 않는 경우가 많고 선행 항암 치료 후에 완전 관해 환자(항암 치료 후 암이 사라지거나 크게 줄어든 상태의 환자)의 경우 수술 병리가 의미를 갖지 않는다는 임상적 현실을 반영한 선택이다.
추론 파이프라인: [영상 → 수치 → 확률]로 이어지는 구조
각 병변에 대해 HDMI 영상이 생성된 후, ROI 내 혈관 구조에서 정량 바이오마커 분포가 계산된다. 중요한 점은 단일 값이 아니라 병변 별로 계산된 지표들의 통계적인 분포가 사용된다는 것이다. 이 정량 지표들은 이후 multivariable logistic regression 모델의 입력으로 사용되며 모델은 병변이 악성일 확률을 연속적인 값으로 출력한다.
본 방식은 “암/비암”의 이진 분류를 강제하지 않고 임상적 불확실성을 확률로 표현한다는 점에서 실제 판독 흐름과 잘 맞는다. 또한 회귀 계수는 각 바이오마커가 진단에 기여하는 방향과 강도를 해석 가능하게 제공해 블랙박스 모델 대비 임상 수용성이 높다.
데이터 분석 및 비교 실험 설계
각 영상에 대해 새로운 HDMI biomarker와 초기 HDMI biomarker의 통계적 분포를 얻은 후 다양한 방법으로 분석하였다. 병리학적 결과를 gold standard로 활용하여 ROC 분석을 통해 양성 및 악성 병변을 구별하는 데 있어 혈관 형태학적 특징의 통계적 유의성을 검증하였다.
또한 각 새로운 biomarker에 대해 서로 다른 병변 크기 조건에 대한 95% 신뢰 구간을 포함한 오차 막대 그래프와 특이도, 민감도, AUC를 얻었다. 통계적 유의성 분석은 Wilcoxon 순위합 검정으로 수행하였고 p value < 0.05를 유의미한 것으로 간주했다.

연구진은 HDMI의 효과를 명확히 검증하기 위해 단계적 비교 실험을 설계하였다. 먼저 기존에 사용되던 initial biomarkers(혈관 밀도 VD, 분기 수 NB, 직경 D 등)만을 사용한 모델과 새롭게 제안된 4가지 HDMI biomarker(mvFD, MD, BA, SVP)만을 사용한 모델을 각각 평가하였다.
이후 두 그룹의 바이오마커를 결합한 모델을 구성하고 마지막으료 여기에 BI-RADS 점수를 추가한 모델까지 확장하였다. 이 비교 구조를 통해, 단순히 “새 지표가 좋다”는 주장에 그치지 않고 어떤 정보가 추가될 때 성능이 얼마나 개선되는지를 정량적으로 보여준다. 이러한 단계적 실험 설계가 결과 해석의 신뢰도를 크게 높였다.
결과 해석
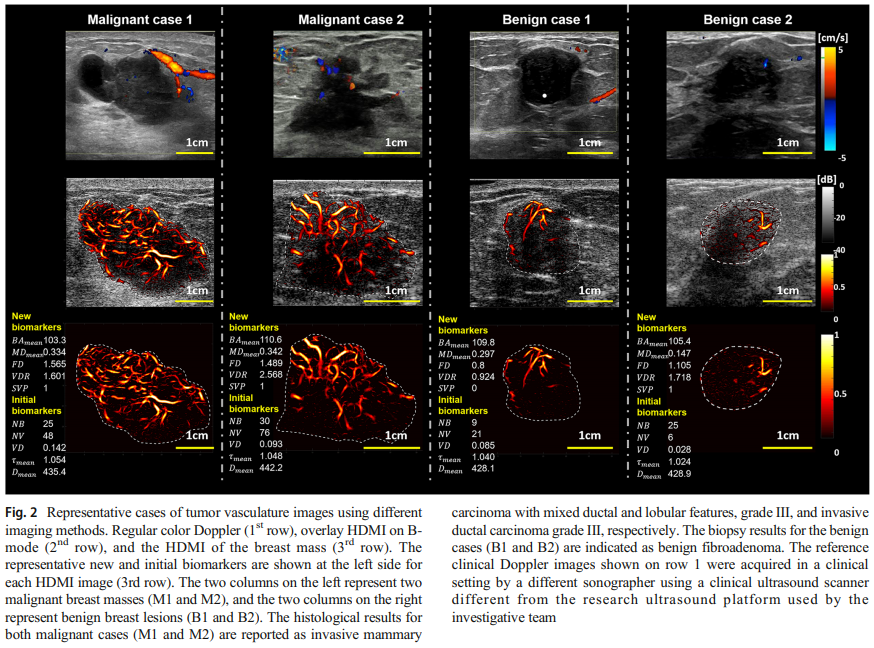
Fig. 2.는 이 논문이 주장하는 가장 큰 부분을 직관적으로 보여주고 있다. 1행의 일반 Doppler image에서는 악성에도 혈류 신호가 있긴 하지만 패치처럼 끊기고 큰 혈관 위주로만 관찰이 된다. 반면 2와 3행(각각 HDMI overlay 및 HDMI only)의 이미지에서는 병변 주변과 내부에 걸쳐 연속적인 미세혈관 네트워크가 드러난다.
이 차이는 단순히 더 선명하다가 아니라 구조 분석 가능 여부를 가르는 요인이 된다. Doppler와 비교했을 때 HDMI는 혈관이 얼마나 복잡하게 분기하는지, 어느 쪽에 몰려있는지(중심/주변), 분기 각이 비정상인지까지 읽게 만든다. 즉, HDMI의 진짜 효용은 morphology(형태학적) 기반의 정량 분석에 있다.
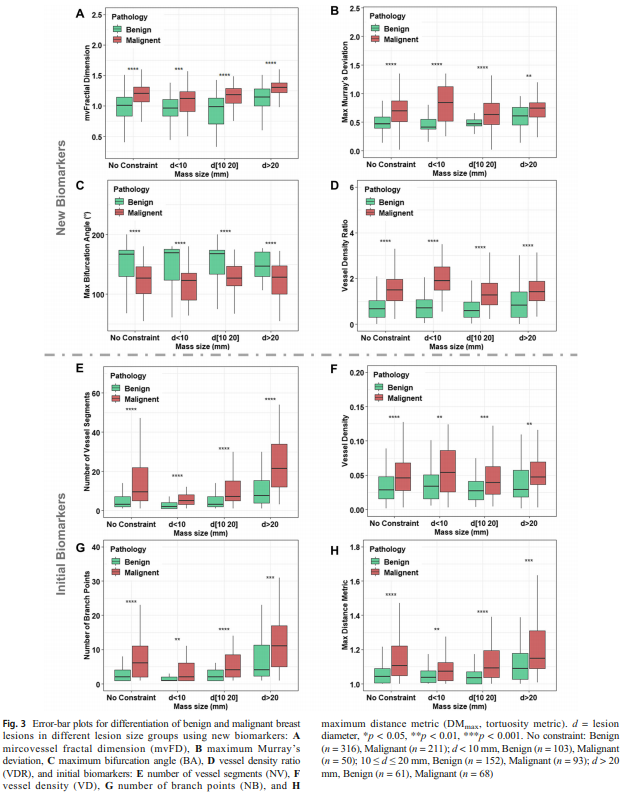
Fig. 3에서는 통계적으로 이 논문이 주장하는 바를 정량 지표로 지지하고 있다. 핵심은 아래 두 가지이다.
(A) - 신규 지표(mvFD, MD, BA, VDR)가 전반적으로 악성과 양성을 유의미하게 나누고 있다.
- mvFD(복잡도): 악성에서 더 높다. ← 종양 혈관이 악성에서 더 복잡하고 불규칙하게 뻗는다는 생물학적 직관과 일치한다.
- MD(Murray’s Deviation; 혈관 분기 법칙 이상도): 악성에서 더 높다. ← 정상 혈관 분기 법칙에서 벗어난 비정상 분기 또는 직경 불일치가 악성에서 더 빈번히 일어난다.
- BA(bifurcation angle): 악성에서 더 낮다 ← 분기각이 좁아지는 경향(더 급한 분기)이 악성의 비정상 혈관 신생의 생물학적 특성과 일치한다.
- VDR(SVP 기반): 악성과 양성에서 분포가 다르다. 단순히 “혈관이 많다”가 아니라 어디에 분포하느냐가 분류력에 기여한다.
(B) - 기존의 biomarker(NV, VD, NB, DM)도 유용하지만 신규 지표보다 한계가 뚜렷하다.
- NV(혈관 segment 수), VD(혈관 밀도), NB(분기점 수) 같은 기존 지표도 악성에서 대체로 증가하지만, 이들은 본질적으로 “양(量)” 중심이다. 반면 신규 biomarker들은 혈관 신생의 “질(質)” 중심(복잡도, 분기 규칙의 붕괴, 분포 패턴)의 평가 지표이므로 종양의 질적 특성이 악성도를 더 직접 반영한다는 해석이 가능하다.

Fig.4는 또 하나의 중요한 메시지를 준다. HDMI biomarker는 단순히 benign과 malignant 분류를 넘어서, 침윤성 암의 grade가 올라갈수록 혈관 네트워크가 더 공격적으로 변한다는 경향을 포착한다.
- mvFD, NV, NB 등이 higher grade에서 더 증가하는 패턴은, 고등급 종양이 더 활발한 혈관 신생, 분기, 복잡도를 가진다는 임상적 직관과 일치한다. 이건 HDMI가 장기적으로는 예후/치료 반응과 연결될 가능성(논문에서도 IHC, subtype 관련 분석을 추가로 수행)까지 시사하는 대목이다.
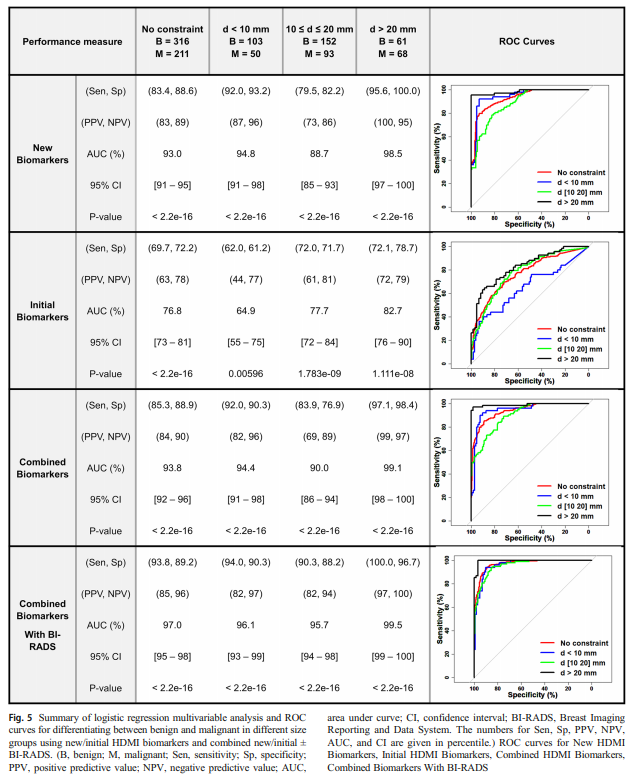
Fig.5는 회귀 모델 성능을 한눈에 보여주는 종합표다.
(A) - New biomarkers만으로도 initial보다 확실히 낫다.
전체 병변(no contraint)기준으로, new biomarker 모델 AUC가 initial biomarker 모델보다 월등히 높다. 즉, 양적 지표보다 혈관의 형태학적 비정상성을 담은 질적 지표가 진단에 더 유효하다는 Fig. 4의 주장은 Fig. 5로 뒷받침된다.
(B) - 병변이 클수록(> 20 mm) HDMI의 장점이 더 극대화된다.
특히 >20 mm 그룹에서 민감도와 특이도가 크게 상승하는 등 new biomarker 조합의 성능이 매우 높게 나온다. 단순히 “큰 병변이 쉬워서”라기보다는, 종양이 커질수록 혈관 신생의 비정상성이 더 누적되고, HDMI가 포착하는 분기, 복잡도, 주변부 집중 패턴이 더 뚜렷해지기 때문이라고 해석하는 게 자연스럽다.
(C) - 기존의 biomarker를 비롯한 BI-RADS를 모두 함께 판단하는 것은 예측 모델의 성능을 크게 끌어올린다.
HDMI는 BI-RADS를 밀어내는 게 아니라, BI-RADS의 구조/형태 평가를 ‘혈관의 형태학적 정량 정보’로 보완할 수 있다. Fig.5에서 “Combined biomarkers with BI-RADS”가 전반적으로 최상위 성능을 보여주는 것은, 회색조 기반 형태학(기존 US) + 혈관 형태학(qHDMI)의 정보가 서로 다른 축의 진단 단서임을 의미한다.
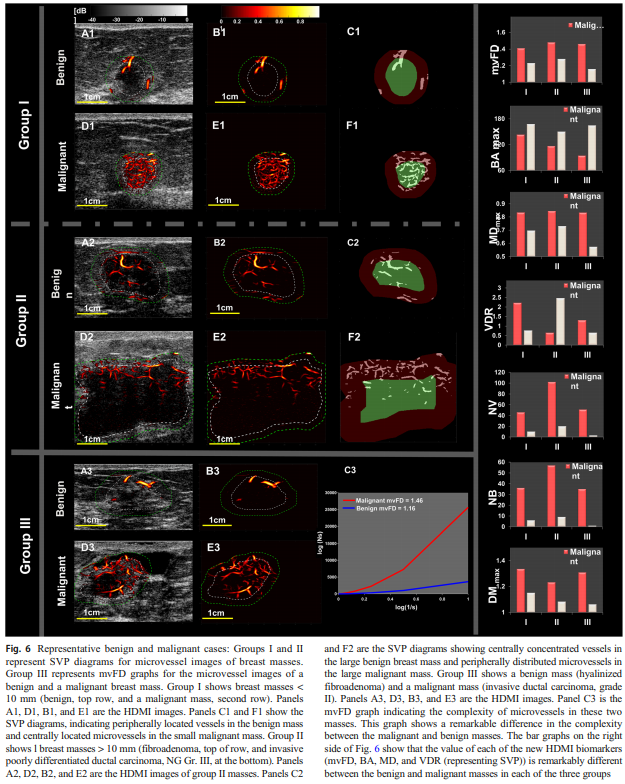
Fig 6. 도 임상적으로 유의미한 특성을 보여준다. 작은 종양과 큰 종양에서 “악성의 혈관 분포 패턴”이 반대로 보일 수 있다.
(A) - Group 1(작은 병변, < 10 mm): 악성은 “중심부 혈관”이 상대적으로 강하다.
Group 1의 작은 병변 사례에서, benign은 주변부 혈관이 malignant는 중심부 혈관이 더 두드러진다. 즉, 작은 악성은 아직 종양-숙주 경계에서 거대 공급혈관이 발달하기 전일 수 있고, 내부의 신생혈관 신호가 더 의미 있게 보일 수 있다는 해석이 가능하다.
(B) - Group 2(큰 병변, > 10 mm): 악성은 “주변부 혈관”이 더 강해진다.
큰 병변으로 갈수록 작은 병변의 임상 특성과 반대 패턴이 나온다. 양성은 오히려 중심부가, 악성은 주변부가 더 두드러진다. 종양이 커지면서 중심부 괴사와 저산소 환경 변화 등으로 혈관 밀도가 상대적으로 줄고, tumor-host interface에서 더 많은 혈관 신생과 굵은 공급 혈관이 발달한다는 종양생물학적 설명과 잘 맞는다.


댓글